部分分解したアロエ多糖類の免疫調整能力
(Modified Aloe barbadensis polysaccharide with immunoregulatory activity)
Planta Med. Artikel 097, Sommer [1], Ausdruck vom 20.12.1999
34/0499/097 Paper Pharmacology
Planta Medica 66 (2000) 1-5
Zhihua Qiu, Ken Jones, Mark Wylie, Qi Jia and Steve Orndorff
Department of Drug Discovery and Screening, Univera Pharmaceuticals, Inc.
Broomfield, CO, USA
概論
アロエ多糖類を、セルラーゼで部分的に分解し、更にろ過により精製し、エタノールにより徐々に沈殿させ、クロマトグラフィに通して分子量別に分離した。この部分分解アロエ多糖類(MAP: modified Aloe polysaccharide)は、マクロファージ細胞の活動を活発化させ、繊維芽細胞の成長を刺激した。天然のアロエベラゲルを同じ状態で試験した場合には、マクロファージを活性化する作用は無かった。部分分解アロエ多糖類(MAP)は、C3H/HeNマウスでの接触性過敏反応(CHS)として測定されるB紫外線(UVB)照射により引き起こされる免疫抑制を防止した。このin vivoの活性は、B紫外線照射により人の皮膚ガン細胞(KB細胞)から放出される腫瘍壊死因子α (TNF-α) を阻害する部分分解アロエ多糖類の活性と相関関係にあった。 平均分子量が8万ダルトンでマンノース、ガラクトース、グルコースの割合が40:1.4:1.0である部分分解アロエ多糖類は、高い割合でアセチル化した直鎖状の高分子である
序文
いくつかの植物の多糖類は、免疫調整作用や、効果的な坑腫瘍、坑ウイルス作用を持っていることは良く知られている(1,2)。アロエは、多糖類を多く含んでいる植物で、外傷治癒作用、消化性潰瘍治癒作用、消炎作用などの多方面の生理活性を持っているため民間薬として古くから世界中で多くの病気に使われてきた(3,4)。以前の研究では、アロエベラの天然のゲルが、不規則ではあるが、B紫外線にあたることで起こる皮膚免疫システムの低下を防ぐ能力があることが指摘されていた(5,6)。いろんな活性は、多分、細菌汚染とアロエゲルに内在する酵素による多糖類の崩壊により引き起こされると考えられる。これらの活性は、例えば、15000ダルトンの多糖類のような、低い分子量の分子で引き起こされると推測されていた。本研究の目的は、最高の免疫調整活性と安定性をもつ部分分解アロエ多糖類の最適の組成を決定することである。
実験材料と方法
植物材料と抽出ゲル
成熟したアロエベラの葉は、アロエコープ(テキサス、アメリカ)の農場で採取した。サンプルの見本は、オースチンのテキサス大学のPlant Resource Center標本室に預けた。外皮を慎重に取り除いて無色の葉肉を採取し、直ちに冷却した。葉肉を綿布で濾すことで繊維質を除去し、アロエベラゲル抽出物(アロエベラゲルジュース)を得た。
アロエ多糖類の分解と精製
アロエベラゲル抽出物は、抽出物1L当たり12mgの割合のセルラーゼ(Cellulase 4000, Valley Research)を入れて室温で2時間培養した。アロエベラゲルの酵素による分解は、最低30分間90℃でその溶液を加熱することで酵素を死活させ終了させた。アントラキノン類や他の着色物質は、1mg/mlの活性炭を入れて1時間放置することで取り除いた。活性炭は、1500回転30分間遠心分離することで取り除かれた。上澄み中の部分分解粗アロエ多糖類の平均収率は、固形物としてリッター当たり4.5gであった。部分分解粗アロエ多糖類は、精製水で長時間透析することで精製した。(分子量1000以下を除去するため。Spectrum Medical Industries) 、次に25%、50%そして80%エタノール溶液で徐々に沈殿させた。50%と80%エタノール溶液での沈殿物を更に Sepharose Cl-4Bカラム(2.5 X 65cm) (Pharmacia)とSephadex G-100カラム(2.5 X 68cm) (Pharmacia)を通して精製した。部分分解精製アロエ多糖類は、精製水で希釈した後、フェノール/硫酸法により比色定量法により定量した(7)。部分分解精製アロエ多糖類の平均分子量は、Superose 12カラム(HR 10/30, Pharmacia)を使って決定した。
アロエ多糖類の組成と関連分析
部分分解精製アロエ多糖類(5mg)の酸加水分解が、200μLの2Mトリフルオロ酢酸(TFA)を100℃4時間反応させて行われた。単糖の組成は、CarboPac PA1カラム(Dionex)を使ってパルス電流検出装置付高速陰イオン交換クロマトグラフィ(Dionex 4500 Chromatography System)(8)で確認された。メチル化とガスクロマト/マススペクトル(GC-MS)を使って、Hakomori (9)とCiucanu (10)の方法に従って部分分解精製アロエ多糖類に結合している物質と多糖類の組成が決定された。
核磁気共鳴スペクトル分析
部分分解精製アロエ多糖類のプロトンと13C-NMRスペクトルが、Varian XL-3000とBruker AC-P 300検出器で測定された。
マクロファージ活動の活発化
既知の方法(11)により生きた腹膜のマクロファージがICRマウスから単離された。細胞は、1皿当たり2 X 105濃度で96枚の皿に移植され、5%濃度の炭酸ガスを含む湿った空気の中37℃で、2時間培養された。牛胎児の血清(FBS, Sigma)を10%含むDulbecco's-modified Eagle's media (DMEM)で3回洗浄した後、細胞は、部分分解粗アロエ多糖類、天然アロエベラゲルそしてリポ多糖類(LPS, 0111: B4, Shigma)と一緒に培養された。 部分分解粗アロエ多糖類は、細胞に加えられる前に0.2μmフィルターでろ過された。24時間後に取り出された培養物は、1250回転で10分間4℃で遠心分離した。上澄みに含まれるTNF-α含量は、Pharmingenから購入したウサギの坑マウス TNF-αモノクロナール抗体とビオチンが結合したポリクロナール坑マウスTNF-α抗体が使われているELISAによって定量した(12)。
B紫外線照射と接触性過敏症の誘発
無菌の雌のC3H/HeNマウスをHarlan Sprague Dawleyから購入し、順応させる為に1週間飼育した。マウスは、無菌室でNational Research Council of Laboratory Animal Care guidelinesに従って飼育された。UVA照射と接触性過敏症の誘発は、Strickandの方法(5)により行った。毛をそったマウスの腹部の皮膚にカバーの付いていないFS20太陽光ランプ(B紫外線範囲280-320nm、λmax = 313nmで約65%のエネルギー)(National Biological Corp.)を2000J/m2の照射量で直接照射した。B紫外線照射後直ちに添加剤(Aquaphorに水、VWR)と部分分解粗アロエ多糖類とAquaphorを1:1の割合で混ぜた混合液をマウスの腹部に塗布した(6cm2当たり約200μL)。3日後、50μLの0.3%ジニトロフルオロベンゼン(DNFB)で毛をそった腹部の皮膚を刺激した。過敏にした後、6日目に各耳の前後の表面に0.2%ジニトロフルオロベンゼンを5μL塗布した。ばね式のマイクロメーター(Mitutoya, Tokyo, Japan)で塗布後すぐと24時間後に耳の厚みが測定された。
人の皮膚ガン細胞にB紫外線を照射するin vitroの実験
人皮膚ガン細胞(KB細胞、American Type Culture Collection)が、培養され、10%FBS、100U/ml硫酸ストレプトマイシンと2mM L-グルタミン(成長成分)を含むeagle's minimum essential medium (MEM, Sigma)の中で保育された。細胞は、100mmの皿に2 X 106の濃度で移植され、48時間後に300J/m2のB紫外線が照射された。B紫外線を照射した細胞は、ろ過滅菌した部分分解アロエ多糖類と天然アロエベラゲルと一緒に0.2%人血清アルブミンを入れたMEMの中で1時間培養された。PBSで1回洗浄した後で、細胞は、成長成分と一緒に更に1晩培養された。培養物は、次の日取り出され、1,250回転10分間4℃で遠心分離された。上澄み液は、遠心分離フィルター(Ultrafree-5K, Millipore)で濃縮された。濃縮物の中のTNF-α含量は、PharMingenから購入したマウスの坑人TNF-α抗体で上記方法で定量した。
細胞増殖
細胞増殖量は、MTT[3-(4,5-dimethylthiazol-2-yl)-2,3-diphenyltetrazolium bromide, Sigma] 比色定量法を応用して定量された。ハムスターの子供の腎臓細胞(BHK-21, American Type Culture Collection)が1皿あたり5000細胞の割合で96皿に移植された。細胞は、ろ過消毒された部分分解アロエ多糖類、天然アロエベラゲルそして繊維芽細胞成長因子(FGF, Sigma) と一緒に牛胎児の血清(FBS, Sigma)を10%含むDulbecco's-modified Eagle's media (DMEM)の中で炭酸ガスを5%含む37℃の湿った空気の中で3日間培養された。
結果と検討
部分分解アロエ多糖類は、マクロファージの活動を刺激する。天然アロエベラゲルには、乾燥重量として約10%、平均分子量として200万ダルトンかそれ以上の多糖類が含まれる。その為、天然の多糖類は、高い分子量のため、天然アロエベラゲルは、通常粘性が高くそして加工がしにくい。セルラーゼによる多糖類の処理は、その処理条件に比例してアロエベラゲルの粘度とアロエ多糖類の平均分子量を非常に低下させる。最高の免疫調節活性のある最善の部分分解アロエ多糖類を決定するために、我々は、酵素と基質の異なる割合でセルラーゼとアロエベラゲルを2時間の間隔で培養し、それらの生理活性を測定した。我々の研究では、平均分子量8万ダルトンの部分分解粗アロエベラゲル多糖類が、B紫外線照射により引き起こされる免疫抑制に対して最も高い保護活性を示した。80℃15分間加熱処理することで、セルラーゼの活性を完全に死活させ、アロエベラゲル多糖類が更に分解して低分子化する事を阻止した(データは表示していない)。
マクロファージは、細胞毒性と食作用により微生物の進入を防ぐことでよく知られている抗体捕捉細胞である。マクロファージを刺激することはこれらの作用を増強することになり、それ故病気治療に応用できる可能性を持っている。マクロファージから放出されるサイトカインの1つであるTNF-αは、免疫防御システムを刺激する情報だけ伝達する重要な役目を演ずる(14)。(サイトカイン:細胞から放出される免疫や細胞間作用に関係している生物活性因子の総称) 免疫システムを刺激するアロエの能力は、ゲルに存在する多糖類によると考えられている(15)。
我々は、アロエ多糖類が、マクロファージを刺激してTNF-αを放出することで免疫システムを刺激すると言う仮説を立てた。この仮説を立証する為に、部分分解アロエ多糖類と天然アロエベラゲルをマウスの腹膜のマクロファージと一緒に一晩培養した。 トリパンブルー排除により決められた実験濃度での細胞に対するサンプルの毒性は観察されなかった。図1に示すように低濃度でのTNF-αの放出量は、非常に低かった(0.84±0.23pg/ml)。部分分解アロエ多糖類の刺激によるTNF-αの放出量は、用量に応じて増加した。
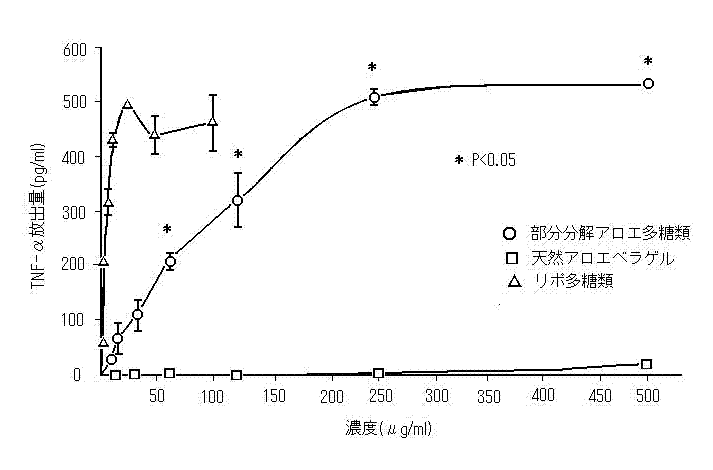
図1.部分分解粗アロエ多糖類と天然アロエベラゲルのマウスの腹膜マクロファージからTNF-αを放出させる効果。各値は、4つの別々の実験から平均値±標準誤差として表されている。同じ状態での部分分解粗アロエ多糖類と天然アロエベラゲルとの間の統計学的有意差(p<0.05)は、ANOVA(1因子)により計算された。
250μg/ml濃度の部分分解粗アロエ多糖類により刺激されたTNF-αの放出量は、506±11 pg/mlである。これは、25μg/ml濃度のリポ多糖類(LPS)により刺激を受けたマクロファージが放出するTNF-α量(492±3 pg/ml)と類似している。同じ条件で、天然アロエベラゲルは、マクロファージからの TNF-α放出を刺激しなかった。部分分解粗アロエ多糖類のマクロファージに対する刺激作用は、アロエに含まれるリポ多糖類(LPS)の為ではない。実験の結果、200ng/mlの濃度のリポ多糖類は、ほんの僅かしかTNF-αの放出を刺激しなかった(8.4±4.9pg/ml)。天然アロエベラゲルと部分分解粗アロエ多糖類に含まれるリポ多糖類の量は、the Limulus Amebocyte Lysate Test (16)で測定すると乾燥物で25ng/mgである。この量は、リポ多糖類の影響を無視できる量である。部分分解粗アロエ多糖類からポリミキシンB―アガロースにより処理してエンドトキシン(内毒素) 除去した後、行った実験でも、類似の量のTNF-α放出が観察された。これらの結果は、アロエベラゲル多糖類がマクロファージ活動を通じて免疫刺激作用を持っていることを示している。
天然アロエベラゲルにマクロファージを刺激する作用が無いのは、天然アロエベラゲルに含まれる不純物が天然多糖類によるマクロファージの活動を阻害しているのかもしれない。In vivoでの多糖類の加工処理がマクロファージの活動を活発化させるために必要である可能性がある。この可能性を証明する為に、精製した天然多糖類をマクロファージと一緒に1晩培養した。その結果、純粋の天然の多糖類は、62.5μg/mlの濃度で有意にTNF-αの放出(462±15pg/ml)を刺激した。しかし、平均12%の多糖類を含み、純粋の天然の多糖類を精製する時のような高い濃度のエタノールを必要としない部分分解粗アロエ多糖類は、天然の多糖類より低い多糖類濃度で僅かに高い刺激作用を示した。この結果は、アロエベラゲルの存在する不純物が天然の多糖類の免疫刺激活性を妨害していることを示唆している。
部分分解アロエ多糖類によるB紫外線照射により引き起こされ皮膚過敏反応の抑制の防止
慢性的に皮膚に紫外線を受けることで人でも実験動物でも皮膚ガンが発生する。B紫外線照射による起こる免疫反応に介在するT細胞の活動抑制が、抗原性の皮膚ガンを引き起こすメカニズムの一つと考えられてきた(17)。以前の研究では、アロエベラゲルの粗エキスを皮膚に塗布することで、B紫外線照射による免疫抑制により起こるマウスの接触性過敏症(CHS)と遅延型の皮膚過敏反応の両方に有効であることが示されている(5)。しかし、アロエベラゲルの免疫保護作用は、原料の製造ロットごとに、又収穫時期、そして、特に原料を作る製造方法により大きな変化がある。従来のアロエベラゲル製品のB紫外線による接触性過敏症の保護効果は、30から100%と幅がある。接触性過敏症保護作用の有効期限は、製造から3から9ヶ月と幅がある。9ヵ月後、ほとんどのアロエベラゲルの製品は、B紫外線により引き起こされる接触性過敏症の抑制を防ぐ能力を失う(6)。
我々は、B紫外線局所照射による免疫抑制モデルでの部分分解アロエ多糖類の皮膚過敏症での保護効果を測定した。2000J/m2のB紫外線を照射したマウスのジニトロフルオロベンゼンによる耳の腫れ(6.02±0.3 X 10-2mm)減少率は、B紫外線を照射しない対照群(14.39±0.49 X 10-2mm)と比較して72.7±1.9%であった。添加剤と部分分解粗アロエ多糖類は、B紫外線照射していない対照群の耳の腫れには効果がなかった。精製と粗の部分分解アロエ多糖類の両方とも、用量に応じたB紫外線による接触性過敏症の阻止効果を示した(図2)。平均耳の腫れ率は、部分分解粗アロエ多糖類(0.5mg in 200μL per 6cm2 area) で12.01±0.36 X 10-2mm 、部分分解精製アロエ多糖類(0.2mg in 200μL per 6cm2 area)で12.44±0.64 X 10-2mmであった。添加剤単独では、B紫外線のよる免疫抑制を防ぐことが出来なかった。同じ条件でのβ-1,3グルカン(0.3mg in 200μL per 6cm2 area)を塗布した耳の腫れは、7.38±0.38 X 10-2mmで、天然アロエベラゲル(0.5mg in 200μL per 6cm2 area)では、7.92±0.65 X 10-2mmであった。
部分分解アロエ多糖類と天然アロエベラゲルを塗布した場合、添加剤だけを塗布した場合に比べて統計学上の有意差があった(p<0.05)。部分分解アロエ多糖類のB紫外線保護効果は、タンパク分解酵素や熱処理にたいして安定であった。そしてそれは、室温での1年以上貯蔵していても安定した効果を持っていた。この結果は、部分分解したアロエ多糖類が免疫保護活性に対する有効成分であることを示唆している。
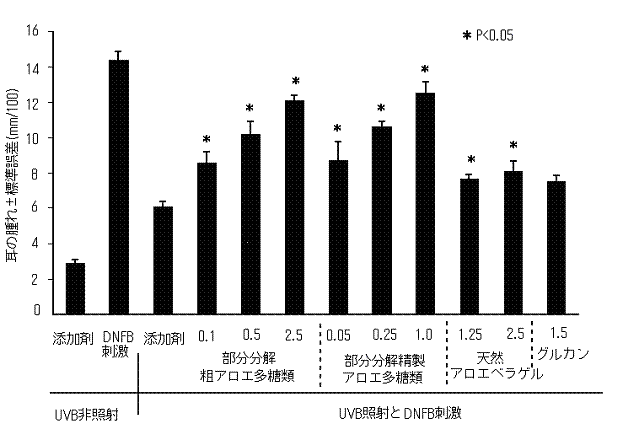 図2.B紫外線による皮膚過敏反応抑制に対する部分分解アロエ多糖類と天然アロエベラゲルの保護効果。各グループは、5匹のマウスを含む。数値は、少なくとも3つ以上の実験結果の平均値±標準誤差を表す。部分分解アロエ多糖類、天然アロエベラゲル、β-グルカンそして添加剤を塗布したB紫外線照射マウスでの試験結果の統計学的有意差(p<0.05)は、ANOVA(1因子)で計算された。
図2.B紫外線による皮膚過敏反応抑制に対する部分分解アロエ多糖類と天然アロエベラゲルの保護効果。各グループは、5匹のマウスを含む。数値は、少なくとも3つ以上の実験結果の平均値±標準誤差を表す。部分分解アロエ多糖類、天然アロエベラゲル、β-グルカンそして添加剤を塗布したB紫外線照射マウスでの試験結果の統計学的有意差(p<0.05)は、ANOVA(1因子)で計算された。
我々が開発した加工方法は、簡単で調節しやすい方法で有機溶剤を使用せずに、均一な品質で再生産可能な方法である。そして、最も重要なことは、より効果的で安定したB紫外線による免疫抑制防止作用を持つ部分分解アロエ多糖類をアロエベラから作り出すことである。その結果、部分分解アロエ多糖類は、皮膚ガンの予防や光線療法による免疫低下の阻止などに広く使用できる。
部分分解アロエ多糖類のB紫外線照射したKB細胞によるTNF-α放出の阻害
TNF-αを皮内注射するとB紫外線照射により引き起こされる皮膚過敏反応の抑制と同じような結果を示すことが報告されている。又、坑TNF-α抗体で中和することでこの抑制を防ぐことが出来る(18, 19)。このことは、TNF-αがB紫外線による皮膚免疫低下に関与する有力な媒体であることを示唆している。最近の研究で、アロエベラゲルのオリゴ糖がB紫外線により引き起こされるPam 212細胞でのインターロイキン10の産生を阻害することも報告されている(6)。
部分分解アロエ多糖類が、B紫外線を照射した人皮膚細胞からのTNF-α放出を阻止することが出来るかを調べる為に、KB細胞に300J/m2のB紫外線を照射し、続いて部分分解アロエ多糖類と天然アロエベラゲルで1時間処理した。B紫外線を照射していないKB細胞からのTNF-α放出量は、検出限界量(0.4pg/ml)以下であった。B紫外線を照射することでKB細胞からのTNF-α放出量が顕著に増加した(4.23±0.61pg/ml)。B紫外線照射した細胞を部分分解粗アロエ多糖類で1時間処理した場合、TNF-α放出量は用量に応じて減少した(図3)。
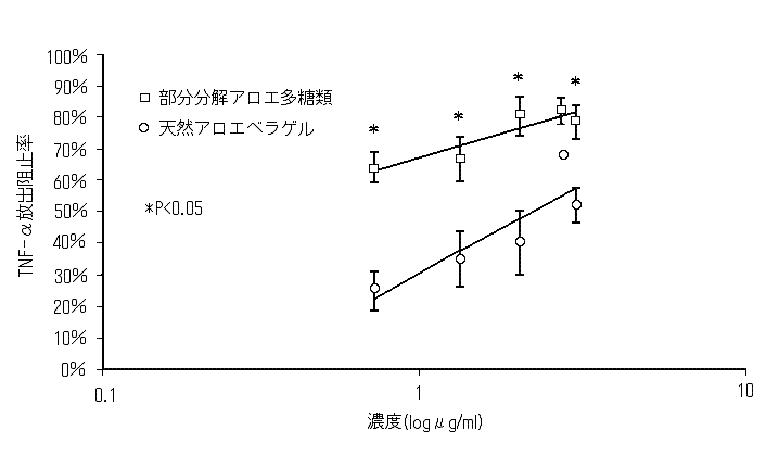
図3 B紫外線照射KB細胞のTNF−α産生に対する部分分解アロエ多糖類と天然アロエベラゲルの効果
値は、3つの実験値の平均値±標準誤差。直線は、マイクロソフトのエクセルで計算した各プロットに対する近似線。部分分解粗アロエ多糖類と天然アロエベラゲル間の同濃度での統計学的有意差(P<0.05)は、ANOVA(1因子)で計算した。
5μg/mlの濃度で、部分分解粗アロエ多糖類は、TNF-αの放出を63.7±5.0%阻止した。同じ濃度の天然アロエベラゲルは、TNF-αの放出を24.4±6.3%阻止しただけであった。試験をしたほとんどの濃度で、部分分解アロエ多糖類のTNF-α放出の阻止作用は、天然アロエベラゲルに比べて統計学的に高かった(p<0.05)。これらの結果は、マウスでのB紫外線による接触性過敏反応に対する部分分解アロエ多糖類の効果と相関関係にある。
TNF-αは、広範囲な生物活性を持つ多機能なサイトカイン
炎症過程での役割と同様、免疫理論上の調整作用を持つサイトカインとしてのTNF-αの役目は、マクロファージ、好中球、好エオシン球の活性化、T細胞やB細胞の機能の増強、他のサイトカインの減少、細胞毒性のあるY細胞の調節などを含む(14,18)。TNF-αの固有の役割は、その放出細胞により異なり、それぞれ1つの情報伝達だけに関与する。部分分解アロエ多糖類は、マクロファージを刺激してTNF-αの放出を増加させる。その結果、宿主の防御システムが高められる。紫外線照射により引き起こされTNF-αの放出の増加は、紫外線照射による免疫反応の抑制を引き起こすことを研究者たちは証明している。ケラチノサイトは、B紫外線の最大の目標であり、TNF-αの発生源である。部分分解アロエ多糖類は、B紫外線による接触性過敏症の抑制を回復することとケラチノサイトでのB紫外線によるTNF-αの放出を阻害する両方の作用を示した。試験結果は、部分分解アロエ多糖類によるB紫外線によるTNF-α放出の阻害は、B紫外線に対する免疫保護作用の1つのメカニズムであることを示している。
細胞増殖での部分分解アロエ多糖類の効果
アロエベラゲルの糖タンパク分画とレクチン様物質が人の細胞とねずみの腎臓細胞の増殖を促進すると報告されている。ゲルに含まれるフェノール化合物のような他の物質は、細胞の成長を阻害するかもしれない(20,21)。しかし、アロエベラゲルに含まれる糖タンパクとレクチン様物質の量は、非常に僅かである。部分分解粗アロエ多糖類は、ほとんどのフェノール化合物を取り除く為に部分的に精製されている。我々は、部分分解アロエ多糖類の細胞増殖刺激作用を測定する為に部分分解アロエ多糖類と天然アロエベラゲルをBHK細胞と一緒に3日間培養した。正の対照群として使った繊維芽細胞成長因子(FGF)は、83ng/mlの濃度で72.7±4.5%BHK細胞の成長を刺激した。
図4に示すように、部分分解アロエ多糖類は、用量に応じてBHK細胞の成長を刺激した。
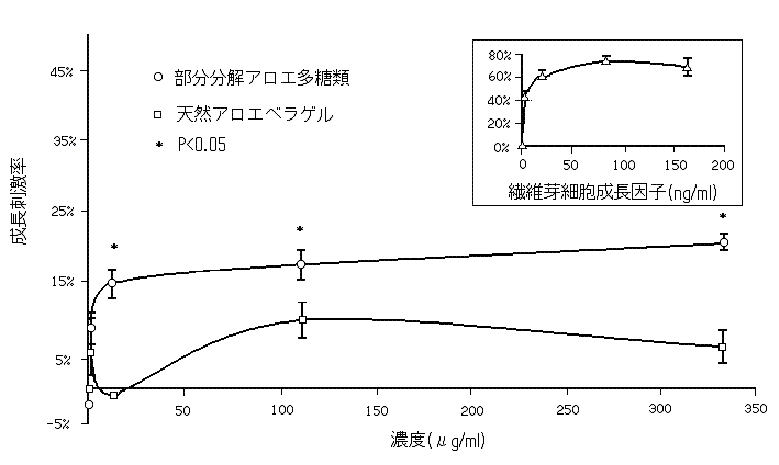 図4.BHK-21細胞の増殖に対する部分分解アロエ多糖類と天然アロエベラゲルの効果
挿入しているグラフは、BHK-21細胞の増殖に関する繊維芽細胞成長因子の刺激効果を示している。値は、3つの実験結果の平均±標準誤差を示している。同濃度での部分分解アロエ多糖類と天然アロエベラゲルの統計学的有意差は、ANOVA(1因子)で計算した。
図4.BHK-21細胞の増殖に対する部分分解アロエ多糖類と天然アロエベラゲルの効果
挿入しているグラフは、BHK-21細胞の増殖に関する繊維芽細胞成長因子の刺激効果を示している。値は、3つの実験結果の平均±標準誤差を示している。同濃度での部分分解アロエ多糖類と天然アロエベラゲルの統計学的有意差は、ANOVA(1因子)で計算した。
12.3μg/mlの濃度で、部分分解アロエ多糖類は、14.6±2.1%細胞の成長を刺激した。天然アロエベラゲルは、細胞増殖に対する活性は低かった。高濃度での試験では、僅かに細胞毒性を示して細胞増殖は低下した。
部分分解アロエ多糖類の組成と特徴
部分分解粗アロエ多糖類は、水に溶け易いくすんだ白色の粉末である。それは、重量として12-15%の多糖類と0.043%以下のタンパク質とアロエベラゲルに含まれる塩類を含んでいる。部分分解精製アロエ多糖類を2Mトリフルオロ酢酸(TFA)で完全に加水分解すると、その単糖の組成は、D-マンノース、D-グルコース、D-ガラクトースと微量のキシロースとアラビノースからなっている。マンノース、ガラクトース、グルコースの分子の割合は、40:1.4:1.0で、天然の多糖類の組成が11:0.2:1であるのに対して非常に大きな違いを示している。新鮮なアロエの葉から取った粘液質のゼリーに含まれる多糖類の組成は、種類により大きな違いがあるように思われる。以前の研究では、アロエは、グルコマンナンが主体でD-ガラクタン、アラビナンそしてペクチン酸も含んでいると報告されている。MandalとDasは、アロエベラから取った純粋のグルコマンナンは、グルコースとマンノースの割合が1:22であると言っている(22)。構造分析から、彼等は、20のマンノシル基からなる繰り返し単位がグルコシル基により結合していると報告している。我々の分析から、グルコマンナンは、
部分分解アロエ多糖類の主要な多糖類であるが、アロエベラゲルを酵素処理して部分分解した為に結合しているグリコシル基が選択的に取り除かれた可能性がある。
部分分解精製アロエベラゲル多糖類の13C-NMRスペクトルは、δ175.5-176.6ppmの間に複数のピークとδ22.7-23.3ppmで強いピークを示している。これは、高い割合でアセチル化した多糖類であることを示している。1H-NMRでの試験では、δ4.69-5.80ppmでの陽子に対するδ2.41-2.06ppmでのアセチルグループの水素の総割合が3:1であった。このことは、糖に結合しているアセチルグループは平均25%であることを示している。13C-NMRは、糖に接続するアセチル基の位置を予測する為の強力な道具である。部分分解アロエ多糖類は、65.6と63.1ppmの2ヶ所で同等の強いピークを持っている。63.1ppmのピークは、通常のD−マンノースのC-6の部位を示す。C-6に結合したアセチル基は、2-3ppmおくれて現れるので、δ65.6ppmのピークは、そこ化学構造と正確に一致する(23)。それ故、ほとんどの加水分解アロエ多糖類のアセチル化は、マンノースのC-6位の水酸基で起こっている。他のアセチル化の位置は、C-2とC-3位又は、C-2,C-3C-6の組み合わせで起こる可能性がある。確な接続形態は、構造が複雑な為決定することが出来なかった。
メチル化とNMR分析の結果、部分分解アロエ多糖類のD-マンノースは、基本的にβ-(1-4)-O-結合をした直鎖の分子であることを示唆している。部分分解アロエ多糖類と八木等によって報告されているキダチアロエ(Aloe arborescens var. natalensis)の天然ゲルに含まれている多糖類C[10%アセチル化している(1-4)-O-β-D-マンナン]を13C-NMRで比較すると非常に類似していることが明らかになった(24)。窒素結合のアセチルグループは、部分分解アロエ多糖類にも天然アロエ多糖類にも検出されなかった。それ故、アロエ多糖類は、ムコ多糖類ではないことを示している。天然アロエ多糖類と部分分解アロエ多糖類の比較は、表1に示す。
表1 天然多糖類と部分分解アロエベラ多糖類の構造比較
| 天然アロエ多糖類 | 部分分解アロエ多糖類 | |
|---|---|---|
| 平均分子量 | 200万ダルトン | 8万ダルトン |
| マンノース:ガラクトース:グルコースの割合 | 11:0.2:1 | 40:1.4:1 |
| 結合形式 | 僅かに糖結合を持つ β1,4結合の直鎖 |
大部分がβ1,4結合の直鎖 |
| アセチル化率 | 19% | 25% |
結論として、我々は、有機溶剤を使用しない活性のある安定したアロエ多糖類の加工方法を開発した。試験結果は、部分分解アロエ多糖類が、多くの生理活性を持つ特徴ある分子量と糖組成を持っていることを示した。部分分解アロエ多糖類のB紫外線による接触性過敏反応の抑制とB紫外線により引き起こされたTNF-αの放出を防ぐ作用は、部分分解アロエ多糖類が日光による皮膚ガンの発生の危険性を低減することを示している。マクロファージの活動と細胞増殖を刺激することは、部分分解アロエ多糖類が免疫増強と外傷の治癒を目的に広範囲な使用できることを示唆している。
謝辞
我々は、八木晟博士(福山大学薬学部教授)から価値ある助言を受けたことに非常に感謝している。我々は、又NMR分析でDr, Bernd Diehl (Spectral Service GmbH, Germany)に、部分分解精製アロエ多糖類の結合解析と分子量の測定でDr. Parastoo Azadi (Complex Carbohydrate Research Center, The University of Geogia, USA)に感謝したい。